Nakita.id - Berikut ini penjelasan mengenai konfigurasi elektron.
Lengkap dengan penjelasannya mulai dari aturan yang berlaku pada konfigurasi elektron hingga hubungannya dengan sistem unsur periodik.
Peserta didik tentu sudah tidak asing lagi kalau membaca unsur periodik, karena memang mereka harus hafal semuanya.
Tapi, unsur periodik tidak langsung muncul begitu saja, ada beberapa tahapan yang harus diketahui dulu.
Mulai dari pembentukan atom sampai pada munculnya sistem periodik unsur.
Nah, materi ini dipelajari oleh siswa SMA kelas XI.
Modul yang digunakan adalah modul Kurikulum Merdeka.
Simak selengkapnya di sini agar lebih paham mengenai pelajaran Kimia bab 1 tersebut.
Bohr menjelaskan bahwa inti atom dikelilingi oleh elektron.
Elektron-elektron tersebut bergerak dalam lintasan-lintasan yang disebut dengan tingkat energi.
Setiap tingkat energi hanya boleh ditempati maksimum 2n 2 elektron.
Baca Juga: Keterkaitan Antara Struktur Sel, Materi Biologi Kelas XI SMA Kurikulum Merdeka
Untuk menjelaskan penempatan elektron dalam setiap tingkat energi tersebut, maka digunakan konfigurasi elektron.
Konfigurasi elektron yang disusun berdasarkan model atom mekanika kuantum harus mengikuti tiga aturan, yaitu:
Wolfgang Pauli pada tahun 1926 mengungkapkan bahwa tidak ada dua buah elektron dalam orbital yang sama memiliki keempat bilangan kuantum yang sama.
Aturan ini dikenal dengan asas larangan Pauli.
Jumlah elektron yang menempati sebuah orbital paling banyak dua yang arahnya berlawanan.
Elektron-elektron cenderung menempati orbital pada tingkat energi terendah.
Aturan pengisian dimulai pada energi terendah ini dikenal dengan aturan Aufbau.
Pengisian elektron dalam orbital dimulai dari orbital dengan tingkat energi paling rendah.
Setelah penuh, pengisian berlanjut ke tingkat energi yang lebih tinggi, begitu seterusnya.
Friedrich Hund pada tahun 1927 menyatakan bahwa elektron-elektron yang berada di suatu orbital menempati orbital yang kosong dengan arah rotasi sejajar.
Setelah semua orbital tersebut terisi satu elektron, elektron-elektron lainnya menempati orbital tersebut dengan arah rotasi yang berlawanan.
Baca Juga: Kunci Jawaban Aktivitas 1.3 Halaman 9 Fisika Kelas XI SMA Kurikulum Merdeka
Aturan hanya berlaku bila ada alternatif pengisian, yaitu orbital p, d, dan f yang tidak terisi penuh, sedangkan orbital yang penuh tidak boleh melanggar asas larangan Pauli.
Penulisan konigurasi elektron dapat ditulis menurut aturan Aufbau (bentuk panjang) atau dalam bentuk pendek.
Konfigurasi elektron bentuk pendek dari suatu unsur dimulai dengan penulisan unsur gas mulia yang nilai konigurasi lebih kecil dari jumlah elektron unsur tersebut, lalu diikuti dengan jumlah elektron yang tersisa.
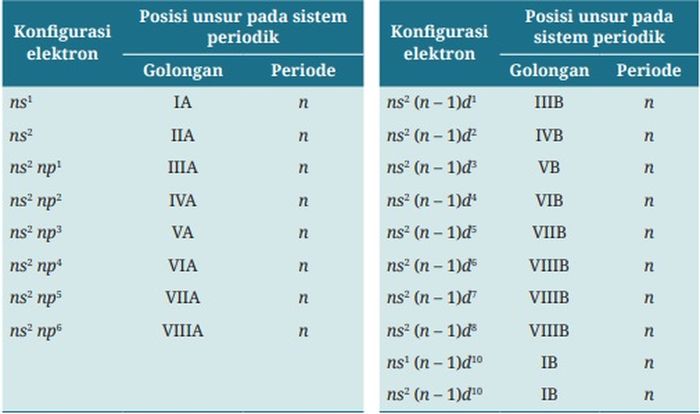
Konigurasi elektron akan menentukan posisi unsur dalam golongan dan periode pada sistem periodik unsur.
Penyusunan unsur-unsur dalam sistem periodik unsur modern berkaitan erat dengan sifat-sifat atom.
Kesamaan sifat atom maupun perubahan sifatnya dapat dikaitkan dengan letaknya dalam periode atau golongan.
Sifat atom meliputi:
- Jari-jari atom
- Energi ionisasi
- Ainitas elektron
- Keelektronegatifan
Baca Juga: Teori Atom Mekanika Kuantum dan Jenis-jenis Bilangan Kuantum, Materi Kimia Kelas XI Kuriulum Merdeka
| Penulis | : | Aullia Rachma Puteri |
| Editor | : | Ratnaningtyas Winahyu |
KOMENTAR