Nakita.id - Berikut ini lanjutan dari Bab III pada Kimia kelas XI, yaitu pengertian Konsep Mol. Simak ringkasan materi di bawah ini.
Bagi kalian yang lupa pengertian mol, mol adalah satuan yang digunakan untuk menunjukkan jumlah zat.
Kalau kita membeli sepatu biasanya dinyatakan dengan satuan pasang, misal dua pasang sepatu. Kalau kita membeli piring, biasanya digunakan satuan lusin (isi 12 buah). Lebih banyak lagi, kalau kita membeli kertas, digunakan satuan rim (isi 500 lembar).
Nah, bagaimana menghitung banyaknya partikel? Satuan apa yang digunakan?
Karena partikel ini sangat kecil dan jumlahnya sangatlah banyak maka untuk mempermudah perhitungan jumlah partikel, para ahli menyepakati satuan yang digunakan adalah mol.
Berapa banyaknya partikel dalam satu mol?
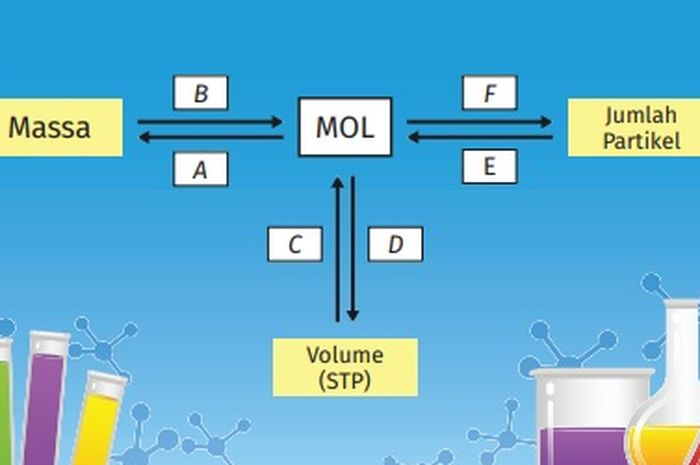
Satu mol menunjukkan banyaknya partikel yang terkandung dalam suatu unsur, ion, molekul, atau senyawa yang jumlahnya sama dengan jumlah partikel dalam 12 gram atom C-12, seperti yang sudah kalian pelajari di kelas X.
Jumlah partikel dalam satu mol adalah 6,022 × 1023, yang dikenal juga sebagai bilangan Avogadro.
1. Hitunglah massa dari 0,1 mol gas karbon dioksida!
Diketahui: 0,1 mol karbon dioksida
Ditanya: massa gas karbon dioksida
Baca Juga: Kunci Jawaban Ayo Berlatih Kimia Halaman 66-67 Kelas XI Kurikulum Merdeka
Jawab:
Massa CO2 = mol × massa molar CO2
= 0,1 mol × 44 g.mol–1
= 4,4 g
2. Hitunglah jumlah mol dari 18 gram air!
Diketahui: massa air 18 gram Ditanya: mol air
Jawab: Mol air = 1 massa 18 g = massa molar 18 g.mol = 1 mol
3. Berapakah jumlah mol dari 11,2 liter gas hidrogen pada kondisi standard temperature and pressure (suhu 273 K dan tekanan 1 atm)?
Diketahui: volume hidrogen pada STP 11,2 liter
Ditanya: mol hidrogen
Jawab: Mol hidrogen = 1 1 volume pada STP 11,2 l = 22,4 l.mol 22,4 l.mol = 0,5 mol
Baca Juga: Kunci Jawaban Latihan Kimia Kelas XI Halaman 61-62 Bagian Essai Kurikulum Merdeka
| Penulis | : | Aullia Rachma Puteri |
| Editor | : | Ratnaningtyas Winahyu |
KOMENTAR